Z czego składa się otaczająca nas materia? Czym jest atom? Z czego jest zbudowany? Czym jest proton, neutron i elektron? Dlaczego elektrony walencyjne są tak istotne? Kilka podstawowych pojęć fizycznych i wstęp do elektrostatyki.
Atomy jako składniki materii
Atomy to podstawowe elementy materii. Są to cząstki niezwykle małych rozmiarów – w jednym ziarnku soli może się ich znajdować aż 1 200 000 000 000 000 000! Atomy jako takie raczej nie lubią być samotne, dlatego chętnie łączą się z innymi, tworząc razem tzw. molekuły. Na przykład w celu stworzenia molekuły wody połączyć musi się jeden atom tlenu z dwoma atomami wodoru (H2O). To jak mocno i jak blisko atomy są ze sobą połączone wpływa na stan skupienia danej substancji. Jeśli atomy są ciasno upakowane i praktycznie unieruchomione, wówczas mamy do czynienia z ciałem stałym. W cieczach molekuły mogą poruszać się znacznie łatwiej, a odległości między nimi są większe. W przypadku gazów molekuły mogą poruszać się niemal swobodnie, do momentu aż nie zderzą się z inną cząstką.

Jak zbudowany jest atom?
Aby zaobserwować zjawiska elektryczne, musimy zejść jeszcze jeden poziom niżej – do budowy atomu. Każdy atom zbudowany jest z tych samych elementów: pewnej liczby protonów i neutronów, tworzących jego centralne jądro, oraz z orbitujących wokół tego jądra elektronów.
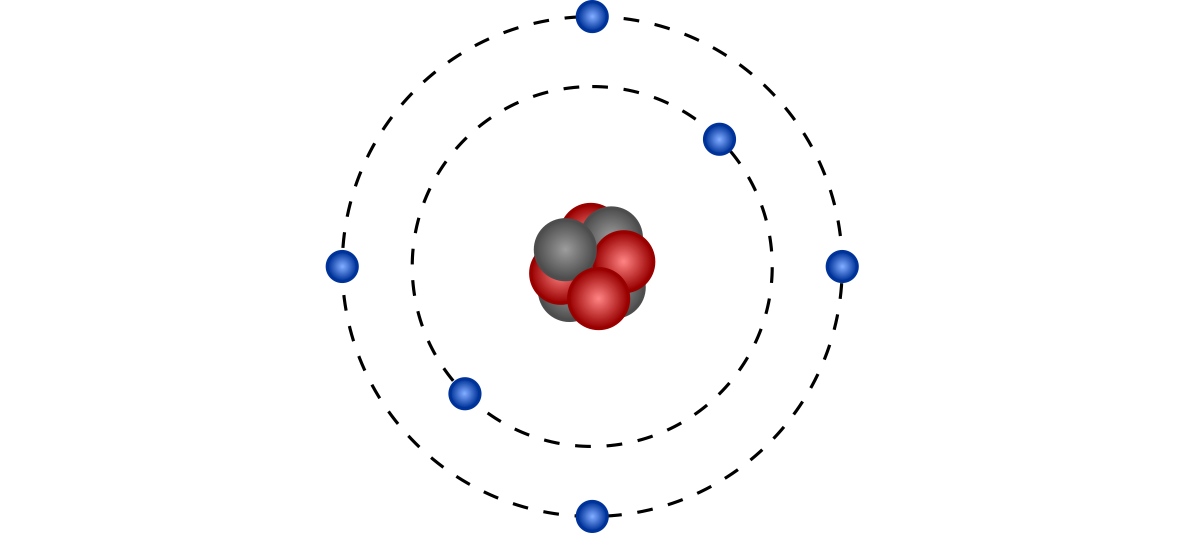
Model widoczny powyżej to jedynie uproszczone przedstawienie tego, o czym w swojej pracy napisał Niels Bohr – jeden z ojców teorii atomowej. W modelu tym protony, neutrony i elektrony traktuje się jak pojedyncze cząsteczki, które teoretycznie da się policzyć, zważyć i zmierzyć ich prędkość poruszania się. Niestety teoria, a praktyka to dwie różne rzeczy i model ten sprawdzał się jedynie w atomach o niewielkiej liczbie cząstek. Problemem nie były uwięzione w jądrze protony i neutrony. Prawdziwe wyzwanie stanowiły szalejące wokół jądra elektrony, które nie do końca zachowują się tak, jak nam się początkowo wydawało. Fizycy byli w stanie określić ich liczbę, ale nie mogli jednocześnie zaobserwować gdzie w danej chwili się znajdują i jak szybko się poruszają. Aby zaradzić powyższym kwestiom, model ten zastąpiono modelem kwantowym, zaproponowanym przez Erwina Schrödingera. Głównym jego postulatem był fakt, że elektron tylko w pewnych sytuacjach zachowuje się jak cząstka, w innych zaś musimy traktować go jak falę (taką jak np. światło). Brzmi skomplikowanie? Chodzi tutaj przede wszystkim oto, że taka dualna natura elektronu sprawia, iż fizycy musieli pogodzić się z faktem, że elektron jest w pewien sposób nieprzewidywalny. Jego stan możemy określić jedynie z pewnym prawdopodobieństwem, co zaowocowało powstaniem zupełnie nowej, rewolucyjnej dziedziny nauki nazwanej fizyką kwantową. W przypadku zjawisk związanych z elektrycznością nie musimy na szczęście wchodzić w te kwestie aż tak głęboko. Prosty w założeniach Model Klasyczny sprawdza się tutaj w znakomitej większości wypadków, dlatego to przy nim pozostaniemy przez większość czasu.
Pierwiastki
Obecnie znanych jest aż 118 różnych atomów (pierwiastków). Każdy z nich posiada unikalną liczbę protonów (od 1 do 118). Możemy ją bez trudu odczytać w układzie okresowym pierwiastków, wraz z innymi interesującymi informacjami.
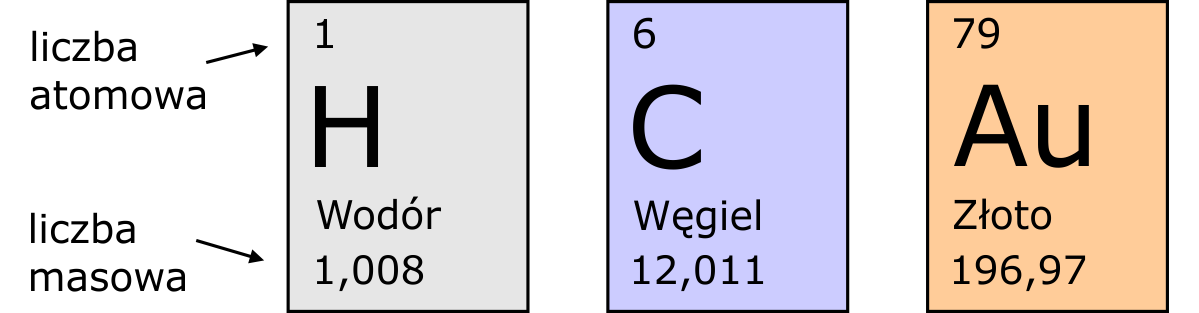
Liczba protonów jest nierozerwalnie powiązana z pierwiastkiem – wodór posiada jeden proton, pierwiastek z sześcioma protonami to węgiel, a złoto to aż siedemdziesiąt dziewięć protonów. O liczbie protonów w jądrze informuje liczba atomowa. Elektronów jest w normalnych warunkach tyle samo co protonów, a różnica między liczbą masową i atomową zdradzi nam ile w atomie znajduje się neutronów.
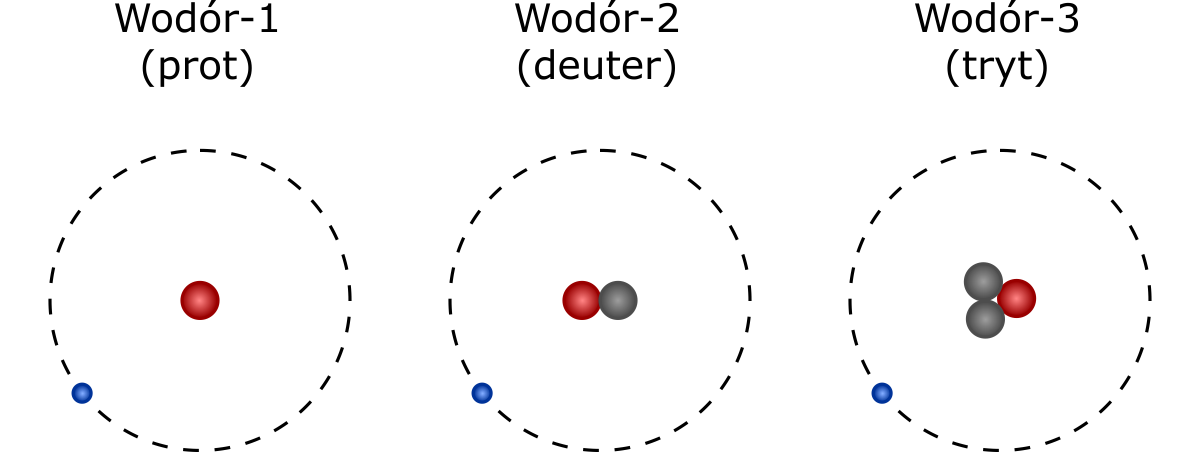
Każdy pierwiastek może występować w kilku wersjach, z różną liczbą neutronów. Wersje takie nazywa się izotopami i różnić mogą się one między sobą właściwościami fizycznymi takimi jak gęstość, czy temperatura topnienia. Poszczególne izotopy oznacza się poprzez dopisanie do nazwy pierwiastka zaokrąglonej liczby masowej (np. złoto-197, złoto-198). Niektóre popularne izotopy dostały specjalne nazwy własne, tak jak widoczne poniżej izotopy wodoru:
Protony, neutrony i elektrony
Masy protonu i neutronu są do siebie zbliżone i obie te cząstki skupiają w jądrze większość masy całego atomu – im więcej cząstek w jądrze, tym mamy do czynienia z cięższym pierwiastkiem. Od tysięcy lat marzono o zamianie bezwartościowego ołowiu w złoto i w ostatnich latach udało się fizykom opracować metody sztucznej modyfikacji atomów. Niestety wszelka taka ingerencja jest niezwykle kosztowna energetycznie (wytworzone złoto nie pokryłoby poniesionych wydatków), ponadto zmodyfikowane cząstki często rozpadają się w ułamku sekundy.
W porównaniu z ciężkim jądrem atomowym, elektrony mają znikomą masę. Podróżują one wokół jądra po przeróżnych, skomplikowanych orbitach. Kształt orbit nie ma dla zjawisk elektrycznych istotnego znaczenia. Ważna jest natomiast ilość elektronów i ich odległość od jądra swojego atomu. Odległość ta zależy od powłoki, na której aktualnie znajduje się elektron. Na dzień dzisiejszy znane nam atomy posiadają od 1 do 7 powłok elektronowych. Liczba powłok i elektronów na konkretnych powłokach jest różna dla każdego pierwiastka, co znacznie wpływa na rozmiary całego atomu. Z punktu widzenia elektryczności istotna jest ostatnia powłoka danego pierwiastka zwana walencyjną (dla atomu krzemu widocznego na poniższym rysunku będzie to powłoka trzecia, a dla wapnia czwarta).

Elektrony walencyjne
Elektrony orbitujące na ostatniej powłoce nazywamy elektronami walencyjnymi. Znajdują się one najdalej od jądra atomowego, a więc siły oddziałujące na nie ze strony protonów i neutronów są najmniejsze. Innymi słowy, jeśli zapragniemy oderwać od atomu jakieś elektrony, to z pewnością najłatwiej będzie oderwać elektrony z powłoki walencyjnej. Zabieg taki w wielu atomach jest niezwykle łatwy. Elektrony nawet bez specjalnych warunków odrywają się od swojego właściciela i przeskakują pomiędzy innymi atomami wokół, tworząc tzw. chmurę elektronową, o której więcej w kolejnych artykułach.
Pomimo tego, że odebrać elektrony niektórym atomom możemy nawet w warunkach domowych, nie oznacza to, że atomy nie zauważają ich braku. Jak wspomniałem, elektrony to cząstki niewielkie i w porównaniu z jądrem atomowym mają znikomą masę. Mimo to utrata choć jednego elektronu walencyjnego zaburzy równowagę elektromagnetyczną atomu. Spowoduje to powstanie siły, poprzez którą wybrakowany atom dążyć będzie do wyrównania liczby cząstek. Ten naturalny mechanizm przywrócenia równowagi będzie źródłem wszelkich zjawisk związanych z elektrycznością. Skąd atomy wiedzą, że brakuje im cząstek? Co powoduje powstanie siły? Odpowiedzi na powyższe pytania znajdziesz w artykułach z serii ,,Elektrostatyka”, a pierwszym z nich jest:
Czym jest ładunek elektryczny? – artykuł na TeoriaElektryki.pl
Dzięki za poświęcony czas!
Bibliografia
1. http://www.physlink.com/education/askexperts/ae342.cfm
2. On the Constitution of Atoms and Molecules – N. Bohr, Philosophical Magazine, seria 6, numer 26, lipiec 1913, s. 1-25
3. Compendium of Chemical Terminology, Gold Book – International Union of Pure and Applied Chemistry
4. Teach Yourself Electricity and Electronics – S. Gibilisco, S. Monk, McGraw-Hill Education








Na pierwszej ilustracji jest zły podpis przy ilustracjach atomów z układu okresowego. Liczba masowa zaznaczona na ilustracji to w rzeczywistości masa atomowa. (liczba masowa musi być liczbą całkowitą – nie mamy połowy protonu czy neutronu).
Zaczęłam czytać Pański blog zaczynając od rozgrzewki i pragnę zwrócić uwagę na błąd na pierwszej ilustracji. Liczba atomowa i liczba masowa muszą być liczbami całkowitymi (nie ma połowy cząstki protonu czy neutronu).Natomiast to, co Pan opisał jako liczba masowa, to w rzeczywistości masa atomowa).
Oo panie, dzięki. Przydało się! Dla uzupełnienia dodam jeszcze inny dobry tekścior ale tylko dotyczący wielkości atomu: https://www.kwantowo.pl/2021/03/08/czy-atomy-maja-podobna-wielkosc/ Krótko mówiąc, tak jak napisałeś „są to cząstki niezwykle małych rozmiarów”, ale warto też wiedzieć, że atom atomowi nierówny a ich średnice mogą się diametralnie różnić. 😉
Lecę do kolejnych tekstów!
Jak najbardziej warto! Dlatego poruszyłem ten temat w artykule o akumulatorach li-ion 🙂
Ciekawe kompendium wiedzy, gratuluję pomysłu i wykonania.
Mam pytanie dotyczące ilustracji:
„…Dwuwymiarowa wizualizacja klasycznego modelu atomu zaproponowanego w 1913r. przez Nielsa Bohra…”
Czy istnieje jakaś trójwymiarowa wizualizacja modelu atomu?
Jeżeli nie modelu kwantowego sprzed wieku, to może tego kwantowego?
Jak wpiszesz w Google grafika „3d atom model” to pewno znajdziesz wiele takich modeli, ale jego rzeczywisty, kwantowy charakter bardzo trudno jest oddać graficznie.
Wow, w kilka minut czytania twojej wypowiedzi nauczyłem się tyle samo co 3 godziny lekcyjne na chemii, Naprawdę robisz świetną robotę! Trzymaj się, PS. Dzięki tobie nauczyłem się grać na gitarze 😀
Ten blog to moje osobiste odkrycie tego roku! Nigdzie jeszcze nie znalazłam tak przystępnie i z pasją podanej wiedzy – dodaję do zakładek i będę wracać codziennie 🙂
Miło słyszeć, że to co tworzę się podoba i do czegoś się przydaje. Dzięki za komentarz!
Nie ma za co! A czy są już lub pojawią się w najbliższym czasie wspomniane dodatkowe artykuły? 🙂 chodzi o te: „Skąd atomy wiedzą, że brakuje im cząstek? Co powoduje powstanie siły? Odpowiedzi na powyższe pytania znajdziesz w kolejnych artykułach.”
Za wszystko co ,,boli” elektrony odpowiada jedno z czterech znanych w fizyce oddziaływań: oddziaływanie elektromagnetyczne. Aby poznać odpowiedzi na postawione na końcu artykułu pytania, musisz przejść do działu Elektrostatyka, w którym to objaśniam ideę ładunku magnetycznego, pola elektrycznego i potencjału. Faktycznie trochę niepotrzebnie zostawiłem same pytania, nie kierując czytelnika na właściwą ścieżkę. Poprawię 😉
Jest to mój pierwszy kontakt z elektroniką. Trafiłem na tą stronę przypadkiem i się zafascynowałem. Czy poleciłby pan jakieś książki dla amatora ? pozdrawiam
Jeżeli chodzi stricte o elektronikę, to sam wychowałem się na książkach z lat 70tych, stąd obecnie nie jestem w stanie niczego wskazać. Za tydzień wrzucę na stronę recenzję książki ,,Elektronika dla małych i dużych”, która to jest wstępem do elektroniki od kompletnych podstaw. Jeszcze jej do końca nie przeczytałem, więc nie wiem czy jestem w stanie ją polecić, więc musisz jeszcze odrobinę poczekać.
Jeśli chodzi o elektrotechnikę, to z książek, które zrecenzowałem w zakładce ,,Polecane książki” początkującym polecam szczególnie: ,,Podstawy elektrotechniki i elektroniki – M. Doległo” oraz ,,Podstawy elektrotechniki w praktyce – A. Bielawski, J. Grygiel”